¿En qué consisten el diagnóstico y el cribado genético preimplantacional en la fecundación in vitro?
El diagnóstico genético preimplantacional y el cribado genético preimplantacional son diversos procedimientos que, combinados, pueden determinar información genética acerca de un embrión antes de que se transfiera al útero. Estos datos permiten tomar decisiones antes de la transferencia y evitar el desarrollo de embriones anómalos en embarazos intrauterinos. De esta forma, se eliminan decisiones posteriores que pueden acarrear conflictos morales y éticos y que resultan necesarias cuando se detecta un embarazo anómalo en pruebas convencionales como la amniocentesis o la muestra de vello coriónico (MVC).
¿Cómo se realiza el diagnóstico o el cribado genético preimplantacional?
Para poder determinar la disposición genética de un embrión antes de su transferencia, es necesario llevar a cabo dos pasos importantes. El primero de ellos es una biopsia del embrión. Este procedimiento consiste en extraer una o más células del embrión para realizarles distintas pruebas. La biopsia del embrión puede tener lugar en el tercer día después de la recuperación de ovocitos (etapa de seis a ocho células) o, como hacemos actualmente, en el quinto día (etapa de blastocisto). El proceso es similar al de la eclosión asistida, en el que se realiza una abertura en la capa externa del embrión por medio de láser. La abertura de la biopsia es algo más grande que la de la eclosión asistida, ya que es necesario retirar células enteras para las pruebas de biopsia. Se trata de un procedimiento extremadamente delicado, ya que la extracción de células de un embrión puede dañarlo y evitar que pueda seguir desarrollándose.
Una vez que se realiza la biopsia, las células se envían a un laboratorio distinto para realizarle las pruebas. Existen pocos laboratorios en Estados Unidos que puedan hacer las pruebas necesarias después de obtener las células. Por tanto, es habitual que el laboratorio de tecnología de reproducción asistida lleve las células al laboratorio específico que se encarga de realizar las pruebas. Mientras, inicialmente, la biopsia del embrión se realizaba retirando una sola célula de un embrión de tres días, ahora hacemos la biopsia en el día cinco exclusivamente. Esto es así porque, cuando un embrión tiene tres días, no todas las células son siempre genéticamente idénticas. A este fenómeno se le denomina mosaicismo. El mosaicismo puede llevar a un diagnóstico erróneo, ya que la célula extraída puede ser la única anómala en un embrión normal o, al contrario, la única célula normal de un embrión anómalo. Sin embargo, un embrión de cinco días ya tiene cientos de células, lo que hace posible extraer de 5 a 10 células para las pruebas. Así, no solo se dispone de más material genético (ADN) sino que se reduce al mínimo el problema del mosaicismo. Tanto nosotros como otros especialistas hemos comprobado que estos procedimientos ofrecen un diagnóstico mucho más preciso y, por tanto, mejores resultados. El segundo paso es la evaluación de la información genética obtenida. Existen dos tipos de información genética que pueden ser de interés. La prueba más común que se realiza es la que determina la disposición de los cromosomas del embrión. El proceso se denomina cribado de aneuploidias, por lo que nos referimos a este tipo de prueba como cribado genético preimplantacional (CGP). Cada embrión normal contiene 46 cromosomas, 23 de los cuales son aportados por el espermatozoide y 23 por el ovocito. Un embrión que contiene 46 cromosomas normales se denomina euploide. Un embrión que presenta más o menos de 46 cromosomas es un embrión aneuploide.
Existen dos tipos de cromosomas, los sexuales, que establecen el sexo del embrión (X e Y) y los autosómicos (1-22), que determinan el resto de características. Los cromosomas autosómicos suelen presentarse en pares, es decir, dos cromosomas 1, dos cromosomas 2, dos cromosomas 3, etc. El espermatozoide aporta un cromosoma sexual (X o Y) y 22 autosómicos. El ovocito aporta un cromosoma sexual (solo X) y 22 autosómicos. El resto de la información genética que podemos evaluar es la presencia o ausencia de un gen específico en un embrión concreto. Esto tipo de información resulta útil cuando uno o ambos miembros de la pareja son portadores del gen de una enfermedad específica. Dado que los datos obtenidos nos permiten diagnosticar una enfermedad en el embrión, nos referimos a este tipo de prueba como diagnóstico genético preimplantacional. El número de enfermedades conocidas que pueden derivarse de una sola anormalidad en el gen crece a medida que los investigadores conocen más datos sobre la composición del genoma humano.
Actualmente los genes sobre los que se realizan pruebas con más frecuencia son los que pueden provocar enfermedades como fibrosis quística, enfermedad de Tay-Sachs, hemofilia y anemia falciforme, pero existen hoy en día más de 1000 enfermedades que pueden diagnosticarse a través de esta técnica. Esta prueba difiere bastante de las pruebas cromosómicas. El tamaño de los cromosomas es muy superior al de un solo gen. Cada gen se compone de una pequeña porción de ADN que, a su vez, está compuesta de combinaciones de cuatro moléculas básicas enganchadas en una secuencia precisa. Cada cromosoma tiene muchos genes, por lo que, para detectar un gen concreto, este debe separarse del cromosoma y copiarse millones de veces para disponer de los suficientes como para que los detectores del laboratorio los localicen. Para ello, es necesario separar el gen del cromosoma por medio de enzimas denominadas endonucleasas de restricción. Estas enzimas disuelven la conexión entre el gen y el cromosoma de forma tan precisa que solo saldrá la secuencia de ADN necesaria. La porción de ADN que corresponde al gen en cuestión pasa después por un proceso denominado reacción en cadena de polimerasas (RCP). La reacción en cadena de polimerasas copia muchas veces la secuencia de ADN en un periodo breve de tiempo. Serán necesarias millones de copias de esta secuencia para que las sondas específicas para el gen puedan detectarlas. Una vez que se ha producido la cantidad de ADN necesaria, la sonda del gen se combinará con el ADN y, si dicho gen está presente, será visible a través de un proceso que permite la visualización de la sonda adherida al gen. Por tanto, si la célula da positivo en la sonda del gen de la fibrosis quística, por ejemplo, se sabrá que el embrión asociado es portador de este gen y no se transferirá al útero.
¿CÓMO SE REALIZA LA PRUEBA?
El proceso de cribado de embriones para la detección de anomalías genéticas es ahora mucho más útil gracias a una tecnología denominada hibridación genómica comparativa (HGC). En la actualidad podemos determinar la composición cromosómica completa de un embrión (los 46 cromosomas) a partir de una sola célula. Cada cromosoma está compuesto de dos tiras de ADN químicamente atraídas la una a la otra de forma que se mantienen unidas en toda su longitud. Las dos tiras de ADN se denominan tiras complementarias, y la hibridación genómica comparativa comprueba los cromosomas utilizando como base esa atracción química de las tiras. En la hibridación genómica comparativa se realizan múltiples copias del ADN obtenido del núcleo de la célula extraída del embrión. A continuación, se separan las dos tiras de ADN (para las pruebas solo será necesaria una tira de cada cromosoma). El siguiente paso es la fragmentación del ADN en porciones muy pequeñas, porciones que se impregnarán de un tinte de color específico. A continuación se divide el ADN de una célula con cromosomas normales en las mismas porciones. Las porciones se impregnan también con un tinte, esta vez de distinto color. Las porciones de ADN de la tira complementaria de las porciones de ADN tintadas que se van a examinar se colocan después en un portaobjetos. Estas porciones de ADN provienen de una célula con cromosomas normales, y están dispuestas en el portaobjetos de forma que componen una micromatriz. Dada su capacidad para atraer la tira complementaria, las porciones de ADN de la micromatriz atraerán las porciones teñidas de ADN cuando se añadan. El siguiente paso es, pues, la adición a la micromatriz de las porciones teñidas del ADN de la célula de prueba y la célula de control. Puesto que cada célula se ha teñido con un color distinto, es posible ver cuánto ADN de cada célula atraen las porciones de ADN de la micromatriz midiendo la cantidad de color que dicha micromatriz presenta. Las porciones de ADN de la micromatriz representan todos los cromosomas de una célula normal y, mediante este procedimiento, puede conocerse la ubicación de todas las porciones que conforman cada cromosoma. Por tanto, es posible determinar cuántas copias de cada cromosoma hay mirando la cantidad de color presente en las porciones de ADN que conforman un cromosoma concreto de la micromatriz. Por ejemplo, si la célula de prueba tiene dos copias de un cromosoma particular, significa que la célula es normal. De esta forma, al examinar la micromatriz, se observaría una cantidad similar de cada color para ese cromosoma, ya que la célula de control también tendrá dos copias de cada cromosoma. Sin embargo, si la célula de prueba tiene tres copias de un cromosoma particular, estaríamos ante una célula anormal, algo que se conoce como trisomía. Este es el caso de la patología conocida como síndrome de Down, donde se dan tres copias del cromosoma 21. La micromatriz de una trisomía presentaría mayor cantidad del color de la célula de prueba que del color de la célula de control.
NUESTROS RESULTADOS EN CRIBADO GENÉTICO PREIMPLANTACIONAL
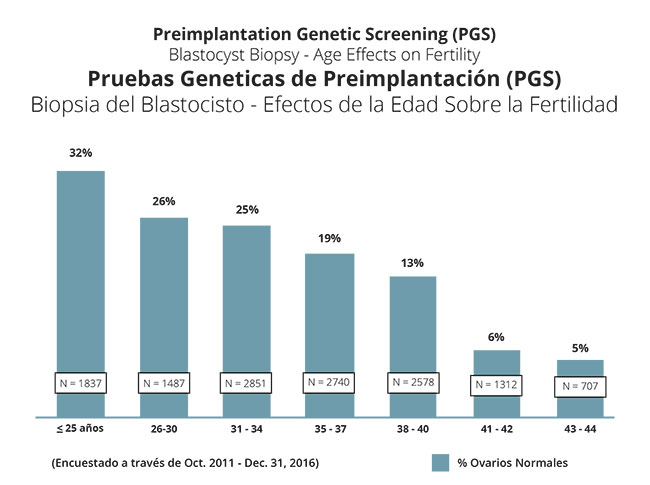
Dado que siempre realizamos el cribado genético preimplantacional en blastocistos (embriones de día 5 o 6) hemos tenido oportunidad de comprobar las mejoras en la precisión del procedimiento, pero también nos hemos dado cuenta de que existen más anomalías genéticas en los óvulos de lo que pensábamos. El gráfico siguiente muestra el porcentaje de óvulos genéticamente normales en mujeres de distintos grupos de edades.
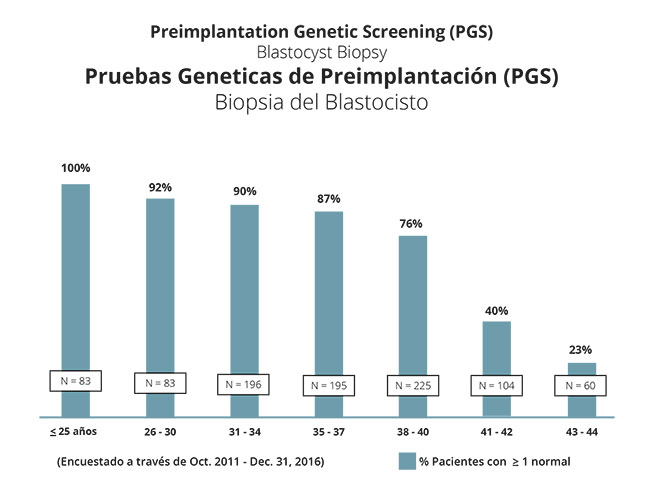
Según estas cifras, las mujeres más jóvenes tienen más probabilidades de obtener al menos un embrión genéticamente normal en el cribado genético preimplantacional que se realiza como parte del ciclo de fecundación in vitro. Como es de esperar, el porcentaje de mujeres con un embrión normal decrece a medida que aumenta la edad. El gráfico siguiente ilustra mejor estas conclusiones. Cabe destacar que, hasta los 40 años, la amplia mayoría de las mujeres obtendrán al menos un embrión normal.
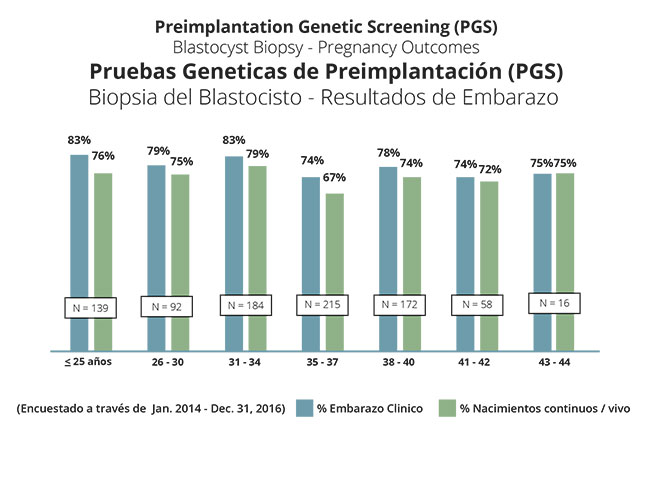
Los resultados obtenidos mediante el cribado genético preimplantacional son mejores de lo que esperábamos al principio. Ahora queda claro que el cribado genético preimplantacional realizado a partir de una biopsia de blastocisto deriva en un aumento de las probabilidades de embarazo para mujeres de todas las edades en proporciones que nunca se habían alcanzado hasta ahora. En la actualidad creemos que el cribado genético preimplantacional es recomendable para todas aquellas mujeres que optan por la fecundación in vitro para mejorar sus posibilidades de éxito. El gráfico siguiente muestra los resultados de embarazo en las pacientes que optan por el cribado genético preimplantacional desde que realizamos en nuestras instalaciones biopsias de blastocisto con vitrificación de embriones.
¿CÓMO USAR LA DETECCIÓN O EL CRIBADO GENÉTICO PREIMPLANTACIONAL?
Ahora que disponemos de esta nueva tecnología, debemos determinar cuándo y cómo utilizarla. Desde el desarrollo de la hibridación genómica comparativa y con el paso a la biopsia de blastocisto, consideramos que el cribado genético preimplantacional es recomendable para mujeres de más de 30 años en cualquier ciclo de la fecundación in vitro. Los datos más recientes demuestran un aumento de la tasa de embarazo en todos los grupos de más de 30 años en comparación con los ciclos en los que no se realiza el cribado. Es importante señalar que logramos estas elevadas tasas de embarazo con la transferencia de solo uno o dos embriones. Es más, los datos sugieren que tenemos más probabilidades de obtener tasas de implantación de embriones más elevadas con la transferencia de un solo embrión en lugar de dos. El cribado genético preimplantacional presenta, además, la ventaja añadida de beneficiar a personas que presentan una disposición genética anómala o que han sufrido abortos naturales recurrentes y que obtienen buenos resultados en el resto de aspectos. Las personas portadoras de enfermedades ocasionadas por el trastorno de un solo gen también pueden beneficiarse del uso del diagnóstico genético preimplantacional. Es importante indicar a las parejas a las que se les ofrece el cribado genético preimplantacional que deben sopesar los riesgos del procedimiento con respecto a sus posibles ventajas antes de tomar la decisión de incluirlo como parte del tratamiento. No obstante, contamos con la experiencia necesaria y sabemos que el riesgo para el embrión en un procedimiento de biopsia es mínimo. Creemos que el cribado genético preimplantacional nos permite maximizar el éxito de la fecundación in vitro y disminuir la incidencia de embarazos múltiples transfiriendo solo uno o dos embriones genéticamente normales.
No obstante, a medida que se extiende el uso del cribado genético preimplantacional, aumenta la posibilidad de su utilización en situaciones que susciten más polémica. Cuanto más aprendemos acerca de la composición del genoma humano y mejor establecemos qué características determinan genes concretos, el potencial de diseñar una ser humano eliminando o insertando genes es cada vez una realidad más cercana. Se trata de un área que acabará convirtiéndose en un tema extremadamente complicado desde un punto de vista ético y moral. Es responsabilidad de la comunidad médica garantizar que esta tecnología se emplea de la forma más sensata. Son problemas difíciles que, a buen seguro, serán el centro de mucho debate en los próximos años. Sin embargo, podemos afirmar que el desarrollo del cribado genético preimplantacional es uno de los logros más importantes y emocionantes en la breve historia de la tecnología de reproducción asistida.
Visite también ChromosomeScreening.org, un recurso de información para pacientes que estén pensando en emplear diagnóstico o cribado genético preimplantacional.